Las proteínas son componentes constitutivos de todos los sistemas biológicos vivos. Son macromoléculas ya que su peso molecular se encuentra generalmente por encima de 10 kDa. Desde el punto de vista químico son moléculas formadas por la unión de veinte unidades monoméricas básicas que son los aminoácidos naturales, a través de enlaces covalentes peptídicos. Son las propiedades físicas y químicas de los aminoácidos las que determinan las propiedades de las proteínas.
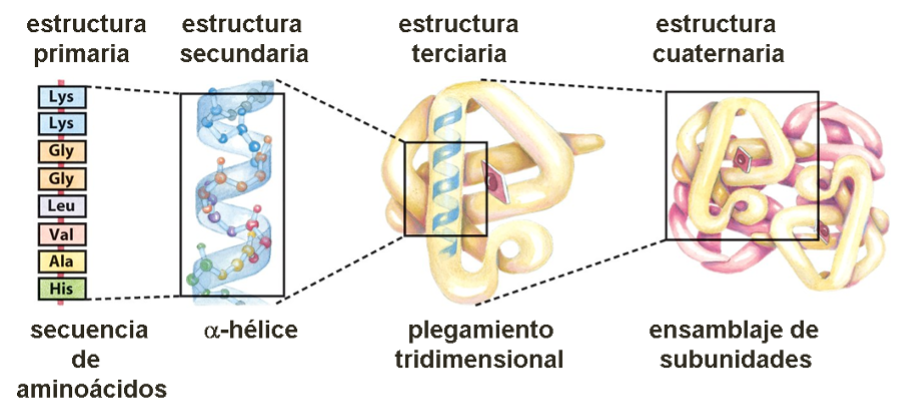
Muchos investigadores se cuestionan sobre la manera en que la proteína adquiere su estructura activa y sobre la forma en la que una determinada secuencia lleva a adoptar una estructura bien característica, el estado nativo, con funciones concretas y especializadas. Con el propósito de evaluar la manera en que la molécula se pliega y de estimar el efecto de las diferentes variables sobre la estabilidad de la proteína, es decir, la tendencia a permanecer en su estado nativo, se ha desarrollado una nueva subdisciplina denominada “plegamiento de proteínas”, en la que se incluye el estudio cinético y termodinámico del proceso de plegado, la estabilidad y la estabilización de una proteína
El tema de la estabilidad de proteínas tiene gran interés tanto por sus implicaciones teóricas, como por su gran interés práctico en diversos procesos industriales, biotecnológicos y bioquímicos. Mucho se ha investigado en este campo y se han realizado avances importantes, aunque la estructuración teórica de un enfoque coherente y predictivo, aún está por establecerse. Los resultados han dado luces sobre los factores que inciden en la estabilidad de las proteínas y han mostrado que para dilucidar la naturaleza de las interacciones que estabilizan la conformación nativa de la proteína y comprender los procesos involucrados en su estabilidad se requiere un entendimiento fundamental de la solvatación de una proteína, es decir, de su interacción termodinámica con el agua, así como con otras especies químicas presentes en las células como sales y otros compuestos.
Vídeo: Estructura y estabilidad de proteínas en 5 minutos:
¿Qué lugar ocupa en Análisis Instrumental?
El seguimiento del proceso de desnaturalización de las proteínas se realiza generalmente a través de la medición de una propiedad física, tal como fluorescencia, absorbancia UV, dicroísmo circular, parámetros de RMN, calorimetría, etc. Las cuales cambian por efecto de variables como la temperatura, presión, pH o la concentración de un cosoluto. Todas estas técnicas instrumentales permiten el estudio de la estabilidad de proteínas, un campo de la investigación de proteínas globulares “modelo”, cuyas propiedades en solución acuosa son determinantes en diversos procesos biofísicos, bioquímicos y fisicoquímicos, así como en sus distintas aplicaciones industriales.






Ingresa tu comentario