En el presente artículo se discute el uso de levodopa como reemplazo terapéutico de la dopamina para el tratamiento de la enfermedad de parkinson y se exponen las bases de algunos mecanismos farmacológicos relacionados con el desarrollo de las disquinesias inducidas por levodopa. Una mejor comprensión del rol de L-DOPA en la enfermedad de Parkinson permitirá el desarrollo de nuevas estrategias farmacológicas y no farmacológicas que permitan ayudar a los pacientes en el tratamiento de la enfermedad y con esto mejorar su calidad de vida.
A pesar de los avances en el tratamiento de la enfermedad de Parkinson (EP), el reemplazo terapéutico de la dopamina por la 3,4-dihidroxifenil-L-alanina (L-dopa) continúa siendo el tratamiento disponible más efectivo para muchos pacientes con el fin de mejorar la función motora que ha sido deteriorada por esta enfermedad. Sin embargo, su indicación es muy limitada; si bien en la mayoría de los pacientes, el tratamiento con L-dopa conduce a un período de “luna de miel” (durante el cual los síntomas motores están bien controlados), después de 5 años de tratamiento, aproximadamente el 40% de los pacientes desarrolla fluctuaciones en el control de los síntomas, y complicaciones motoras, conocidas como disquinesias inducidas por Levodopa (DILs) [1,2,4,5].
La L-dopa y la progresión de la enfermedad conllevan a hacer distintos ajustes tanto en el número de tomas como en la dosis de medicación.
Es necesario realizar una exploración previa de los términos que se utilizarán en el desarrollo del presente ensayo antes de abordar como tal el tema de discusión. El primer término a aclarar son las disquinesias inducidas por Levodopa (DILs) que corresponden a un fenómeno motor complejo relacionado con el uso a largo plazo de L-dopa. Consisten en la ejecución de movimientos anormales estereotipados que afectan principalmente los músculos de la cara, el cuello, extremidades superiores e inferiores, y el eje del cuerpo. Las disquinesias, en etapas iniciales no suelen molestar al paciente, pero en las posteriores pueden reducir la calidad de vida, incrementar la presencia de trastornos anímicos como la depresión e incluso llegan a afectar al paciente económicamente debido al coste del tratamiento. Además, en fases avanzadas pueden ser incapacitantes. [1]
La disquinesia tardía en adelante debe ser entendida entonces, como el efecto secundario y adverso de los medicamentos usados para controlar la esquizofrenia y otras psicosis. Este trastorno resumiendo, consiste en movimientos molestos e involuntarios del tronco, cara y extremidades. Dentro de los síntomas típicos se pueden incluir el sorber o parpadear repetidamente, retorcer lentamente las manos entre otros. [1, 6]
Existen distintos tipos de clasificaciones en la literatura. Dentro de la clasificación clásica se encuentran las:
1) Disquinesias de beneficio o "dosis máxima" que son movimientos coreicos con afectación predominante de la cara, el tronco y las extremidades superiores, éstas están relacionadas con las concentraciones altas de levodopa en el plasma o con un exceso de dopamina disponible a nivel estriatal, y aparecen en periodos en los que el paciente goza de buena movilidad. [1, 3, 4].
2) La Distonía “off” que es una postura diatónica a menudo dolorosa, que aparece temprano en la mañana o en la noche, en un período en el que el paciente no se encuentra bajo los efectos de la medicación o cuando los niveles plasmáticos de levodopa son muy bajos. [1, 3, 4].
3) Disquinesias bifásicas, que aparecen durante los periodos en los que L-Dopa empieza a hacer efecto o está dejando de hacerlo. Éstas suponen una situación intermedia, en la que el paciente tiene una mala movilidad en determinados segmentos corporales y buena movilidad en otros. [1, 3, 4].
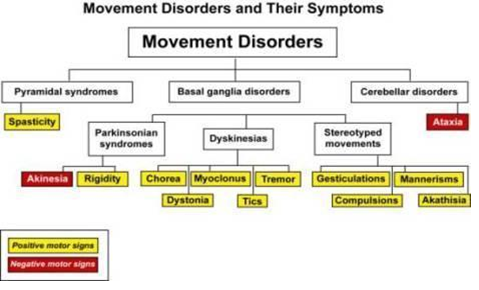
Figura 1. La disquinesia ubicada dentro de los Trastornos del movimiento y sus síntomas. [11] (Tomado de http://www.psicofarmacos.info/?contenido=antipsicoticos&farma=taractan-truxal)
El término "cebado" se refiere al fenómeno de sensibilización conductual y molecular que ocurre después de la primera dosis de L-Dopa, éste no se encuentra necesariamente asociado con la expresión de disquinesia, pero por definición conduce a cambios en la respuesta a los desafíos posteriores a L-Dopa que resultan en la aparición de disquinesia evidente y su posterior desarrollo de un fenotipo más grave. Una vez que se ha producido el cebado, dosis bajas de L-Dopa o agonistas de dopamina son suficientes para provocar disquinesia, y su ventana terapéutica se estrecha. Por último, se hace la aclaración de que, a lo largo del artículo, el término “L-Dopa” se refiere a la combinación de L-Dopa y un inhibidor de la AADC (Aminoácido Aromático L-descarboxilasa, por sus siglas en inglés). [6]
Según el modelo clásico de la organización funcional de los ganglios basales, la corteza cerebral envía entradas glutamatérgicas excitatorias al cuerpo estriado, éstas son moduladas por proyecciones dopaminérgicas que ejercen un efecto de excitación a través de los receptores de dopamina D1 y sobre la sustancia P a través de receptores de dopamina D2; mientras el núcleo subtalámico por su lado emite axones glutamatérgicos hacia las estructuras de salida de los ganglios basales. Las vías directas e indirectas ejercen efectos opuestos sobre el movimiento y un desequilibrio en su actividad se cree que lleva a trastornos del mismo, a saber: hipocinética (es decir, parkinsonismo) o hipercinética (es decir, disquinesia). De acuerdo con este modelo, en el estado disquinético, la administración de L-Dopa conduce a una actividad excesiva de las neuronas de proyección de la vía directa pero ésta resulta en una reducción en el actividad a lo largo de la vía indirecta, estos dos efectos conllevan a una sobreexcitación cortical y disquinesia, de acuerdo a lo anterior, se han realizado estudios metabólicos de neuroimágen que han demostrado hiperactividad del área motora suplementaria y de la corteza motora cuando los pacientes Disquinéticos con Enfermedad de Parkinson (EP) son comparados con los pacientes no-disquinéticos con EP y con sujetos normales. [6]
Sin embargo, esta explicación clásica de la fisiopatología de la disquinesia es demasiado simple y no se puede considerar como una teoría completa sino como un modelo para construir una hipótesis que ayude a explicar la fisiopatología de la enfermedad como tal. Ejemplo de lo anterior es el hecho de que según el modelo clásico de los ganglios basales, las lesiones o la estimulación cerebral profunda del GPi (Globus pallidus interno) debe suprimir la inhibición tálamo-cortical, lo que resulta en una exacerbación de la gravedad de la disquinesia, sin embargo es lo contrario, lo que se ve experimentalmente en el PNH y en la clínica. [6]
Los mecanismos que conducen al desarrollo y expresión de la disquinesia no se entienden plenamente hasta la fecha, pero se ha podido llegar a establecer la participación de varios sistemas de neurotransmisores, entre ellos los sistemas dopaminérgicos y no dopaminérgicos, incluyendo el glutamatérgico, los opioides, el serotonérgico, el ácido g-aminobutírico (GABA), la adenosina, los cannabinoides, los adrenérgicos, los histaminérgicos, y los sistemas colinérgicos [2].
A continuación, se explicarán algunos de ellos:
- Sistema Glutamatérgico.
El ácido glutámico es el neurotransmisor más abundante del sistema nervioso. Las neuronas glutamatérgicas se extienden a lo largo del eje encefalomedular y sus fibras abarcan amplios sectores del eje encéfalo-medular y del sistema nervioso periférico para constituir vías ascendentes, descendentes, asociativas y microcircuitos locales. El glutamato ejerce sus efectos a través de receptores ionotrópicos y receptores metabolotrópicos y juega un papel importante en la plasticidad sináptica.
El glutamato que se utiliza como neurotransmisor se almacena en vesículas. Éstas lo atrapan con la ayuda de moléculas que se localizan en la membrana vesicular, las cuales se conocen como transportadoras de glutamato vesicular. Así, el transportador lleva al interior el glutamato gracias al intercambio de protones; mientras que la asociación entre las vesículas y el citoesqueleto permite su transporte hacia la membrana presináptica de manera que se encuentren disponibles para la exocitosis.
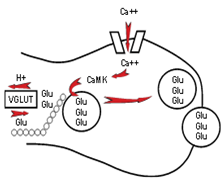
Figura 2. Transporte de glutamato hacia la membrana presináptica (tomado de http://www.redalyc.org/articulo.oa?id=806031302)
La liberación del glutamato, ocurre cuando la vesícula se fusiona con la membrana presináptica, por medio de la interacción con proteínas presentes en la membrana de las vesículas, en el citoplasma y en la membrana presináptica. Estas proteínas tienen la capacidad de formar un sistema de anclaje, que se activa con la entrada de calcio a la terminal presináptica.
Varios estudios postmortem y farmacológicos han demostrado la participación glutamatérgica en la disquinesia. Se cree que la hiperactividad glutamatérgica es un importante contribuyente tanto en el desarrollo y la expresión de dicha patología, en particular, “el modelo clásico sugiere hiperactividad de proyecciones glutamatérgicas corticostriatales como elemento crítico para la hiperactividad de la vía directa. Esto sugiere que hay otras áreas involucradas, en las que se aumenta la transmisión.
1.1. Receptores ionotrópicos del ácido glutámico
Los receptores ionotrópicos son canales de cationes que cuando se abren, permiten la entrada de sodio y de calcio y la salida de potasio. Existen tres tipos: NMDA, AMPA y Kainato.
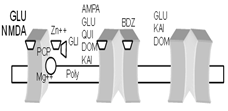
Figura 3. Receptores ionotrópicos del ácido glutámico (tomado de http://www.redalyc.org/articulo.oa?id=80631302)
- Los receptores NMDA
Los receptores de NMDA constan de tetrámeros que comprenden al menos una subunidad NR1 y una NR2 (NR2A - D ), aunque también pueden contener una NR3. El glutamato se une a las subunidades NR2, siendo las subunidades NR2A y NR2B las de principal estudio en el campo farmacológico a nivel de disquinesia.
Desde 2006, la Academia Americana de Neurología ha recomendado el uso de amantadina para el tratamiento de disquinesia La acción de amantadina es reducir la dosis máxima LID establecida sin comprometer los beneficios antiparkinsonianos, y el antagonismo no selectivo de los receptores NMDA es considerado como el mecanismo mediante el cual amantadina, dextrorfano y dextrometorfano ejercen sus efectos antidisquinéticos. Sin embargo, la amantadina no es universalmente eficaz y puede ser mal tolerada por algunos pacientes, y puede provocar complicaciones psiquiátricas.
Con respecto a la expresión de la disquinesia aguda, el bloqueo del canal iónico de NMDA por la administración de sulfato de magnesio antagoniza el sitio de unión de glicina mediante el aumento de los niveles de ácido quinurénico sin modificar los efectos antiparkinsonianos.
- Los receptores AMPA
Este tipo de receptores posee un canal que media más rápido la aparición de un potencial postsináptico excitatorio después de la liberación de glutamato. “Las subunidades que lo conforman están codificadas por una familia de cuatro genes, GLUR1 a GLUR4, que forman receptores heterologomérico dentro de la membrana” (7). Responden químicamente a quisqualato, AMPA, kainato y glutamato, pero no a NMDA y presentan un sitio modulatorio externo para cierto tipo de benzodiacepinas.
Estudios post mortem sugieren la falta de participación de la subunidad GluR1 en LID. Por lo tanto, aunque el destino de receptores AMPA en la disquinesia ha sido mucho menos estudiada que el destino de los receptores NMDA, se puede evidenciar que la transmisión anormal de GluR2 / 3 parece ser un causal en la disquinesia. Las causas por las cuales los niveles en AMPA se incrementan en la disquinesia aguda en pacientes tratados con apomorfina, sigue siendo desconocido. Un aumento en la transmisión glutamatérgica mediada por AMPA a lo largo de la vía directa podría explicar su hiperactividad en la disquinesia.
“...Estudios farmacológicos, han demostrado que los antagonistas GluR2 /NMDA (IEM-1460), los antagonistas de AMPA / kainato (Y-300,164) y el topiramato reducen la gravedad de la disquinesia. Además, la administración de dosis subumbral, de antagonistas de AMPA / kainato (GYK-47,2) en combinación con dosis bajas de cualquiera de los antagonistas no selectivos de NDMA (MK-80) o amantadina llevaron a una reducción significativa en la disquinesia…” [6]
Por el contrario, el fármaco Perampanel , aunque es altamente selectivo para los receptores de AMPA no alivia la disquinesia, según ensayos realizados en fase II. Estos resultados arrojan serias dudas sobre la eficacia de los antagonistas de AMPA, debido a que el Perampanel es altamente selectivo para los receptores de AMPA, de hecho, más selectivo que cualquiera de los fármacos citados en el párrafo anterior.
1.2. Receptores Metabolotrópicos de Glutamato
Los receptores metabolotrópicos del ácido glutámico son proteínas de membrana del tipo de los receptores ligados a proteínas G. Se conocen ocho subtipos que se denominan mGlur 1 a mGlur 8 y su localización puede ser presinaptica o postsináptica.
La falta de participación de los receptores mGlu2 / 3 receptores en LID fue sugerido por un estudio farmacológico realizado en ratas lesionadas con - 6 - OHDA en el que el agonista mGlu2 LY -379, 268 no tuvo ningún efecto en la prevención del desarrollo o la supresión de la expresión de forma aguda de LI -AIMS. La eficacia antidisquinetica del antagonista del receptor mGlu2 / 3 en clínica ha sido probada, pero debido a los estudios farmacologicos es poco probable continuar por esta vía.
Los receptores mGlu5 son abundantes en el cuerpo estriado, donde se ubican postsinápticamente en las neuronas de proyección. Los mGlu5 y los receptores NMDA parecen estar íntimamente conectados, con una interacción recíproca de la retroalimentación positiva, y, como tal, antagonizar los receptores mGlu5 es otra forma de reducir la transmisión hiperactiva glutamatérgica en LID. A nivel clínico, AFQ056 es el único antagoista mGlu5 del que se ha informado de aliviar con éxito la LID.
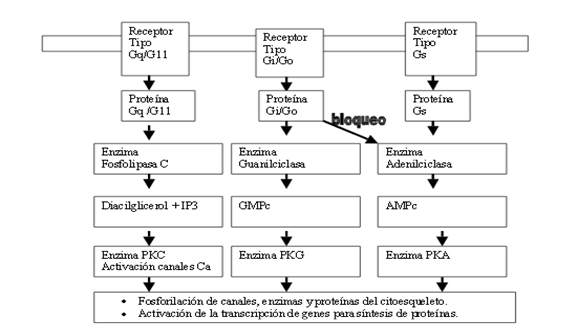
Figura 4. Señales intracelulares disparadas por los receptores ligados a proteínas G. (Tomado de http://www.redalyc.org/articulo.oa?id=80631302)
1.3. Liberación de Glutamato
La disminución en la liberación de glutamato puede ser una manera eficaz para aliviar disquinesia. Por lo tanto, el inhibidor de la liberación de glutamato Riluzol está establecido para el alivio y la disminución disquinesia grave en un pequeño estudio piloto. Del mismo modo, otro inhibidor glutamatérgico, la naftazona, tiene estos mismos efectos. Pero ni riluzol ni naftazona ofrecen beneficios antiparkinsonianos.
El sistema Opioide
- Preproencefalina y Preprodinorfina
El alto peso molecular del precursor opioide preproencefalina -A (PPE -A ) se expresa por la vía indirecta de neuronas estriatopalidales, mientras que preproencefalina -B) se expresa por la vía directa en neuronas de estriatonigral. PPE-A pueden ser procesados para generar leucina (Leu) -encefalina y metionina ( Met ) - encefalina mientras que el PPE -B contiene los determinantes para neoendorfina , dinorfina A, y leumorfina.
- Receptores opioides
Al realizar la evaluación de pacientes que presentan disquinesia, parkinson y pacientes sanos, en cuanto al comportamiento que presentan los receptores opioides, se debe realizar un análisis del fármaco suministrado para tratar la enfermedad, del tiempo en el cual se administró antes de realizar el análisis, así como el efecto que presenta el activo a nivel del sistema nervioso de cada paciente.
Hout, et al., en el 2013, plantea que los receptores del sistema opioide se encuentra alterado en todos los pacientes que presentan Parkinson y disquinesia, justificado en estudios donde se evalúa el comportamiento de cada tipo de receptor opioide en zonas específicas del sistema nervioso central (globus pallidus, putamen, corteza motora y premotora), y tiempos determinados ante el suministro de un tratamiento farmacológico (L-DOPA y MPTP), en animales sanos y que presentaran alguna de las enfermedades:
- Receptor m: Es difícil establecer una relación generalizada de este receptor de acuerdo a la aparición de una determinada enfermedad (Parkinson o disquinesia) empleando un tratamiento establecido. Aubert et al., 2007 realizando estudios farmacológicos encontró que el tratamiento con L-DOPA puede ocasionar una disminución de estos receptores a nivel del putamen ventrolateral y en los pares internos del globus pallidus, mientras que con MPTP estos receptores en dichas zonas no se alteran, pero si se presenta una alteración en los pares externos del globus pallidus, viéndose disminuido dicho efecto gracias al suministro de L-DOPA, por lo cual se puede decir que este último es un efecto reversible.
Por otro lado, Johansson et al., en su estudio realizado en el 2001 plantea que al lesionar individuos con 6-hidroxidopamina, y con esto, la aparición de disquinesia, describe que el comportamiento de este tipo de receptores es verse incrementados en la corteza motora y premotora, además refiere que a nivel de los ganglios basales en Parkinson se presenta una disminución de los mismos. Además se puede decir que el tratamiento con L-DOPA en individuos que presentan Parkinson alteran (disminuye) los niveles de unión de estos receptores en el núcleo caudado y putamen.
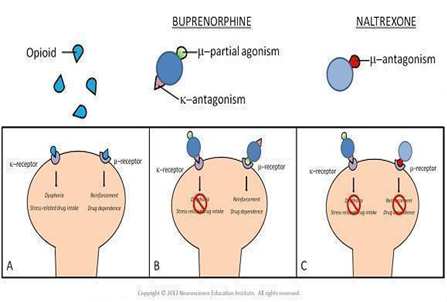
Figura 5. Unión agonista o antagonista de fármacos a nivel de receptores opioides (http://www.cnschronicle.com/wp-content/uploads/2012/12/Wee-Fig-1.jpg)
La alteración en la cantidad y/o en la funcionalidad de este receptor no es determinante para establecer el estado de disquinesia presente ya que otros factores como el estado de fosforilación o la membrana contra la distribución subcelular, también deben ser alteradas en el estado disquinésico.
- Receptor d: Aubert et al. en el 2007 encontró que al inducir la disquinesia con L-DOPA, no se altera de forma generalizada sino que cada región presenta características determinadas, por otra parte, se ha descrito que al suministrar 6- hidroxidopamina el comportamiento que presentan estos receptores es aumentar sus niveles tanto en la corteza motora como en la premotora. Farmacológicamente se puede tratar este comportamiento suministrando el antagonista de receptores d como lo es el naltridol, quien tiene la ventaja de no alterar el comportamiento como antiparkinsoniano de la L-DOPA. [10]
- Receptor k:
Principalmente, L-DOPA ocasiona una disminución en los niveles de este receptor tanto en los pares internos como externos del globus pallidus, mientras que individuos lesionados con 6-hidroxidopamina se observa dicha alteración a nivel del cuerpo estriado y sustancia nigra, por lo cual, se puede establecer que de acuerdo al tratamiento o a la exposición que presente el individuo ante determinada sustancia tendrá al igual que en los receptores m y d, una alteración variada a lo largo de las zonas del sistema nervioso central implicadas en la expresión de disquinesia.
Sistema serotoninérgico
Hout, et al., en el 2013 describe que este es uno de los sistemas menos estudiados en la influencia que presenta en la disquinesia inducida por L-DOPA, en comparación con otros sistemas como el dopaminérgico y glutamatérgico, aunque se dice que desempeña un papel fundamental en la fisiopatología mediante este proceso disquinésico.
El sistema serotoninérgico es un mecanismo intermediario mediante el cual se producen las transmisiones dopaminérgicas y glutamatérgicas anormales en el cuerpo estriado, por lo cual, se puede decir que el sistema de receptores de serotonina aparece en la disquinesia inducida por L-DOPA como un modulador de neurotransmisores disquinésicos como dopamina y glutamato, aunque este mecanismo es aún incierto ya que no se ha podido describir la forma en la que se une a los receptores de membrana, ni como funciona el mecanismo de segundos mensajeros dentro de cada sistema (Hout et al., 2013).
Sistema GABAérgico
El acido gama amino butírico (GABA) Figura 6, es un aminoácido biosintetizado a partir del glutamato y se reconoce como el neurotransmisor inhibitorio por excelencia. Este neurotransmisor actúa principalmente a nivel de dos receptores GABAA y GABAB.
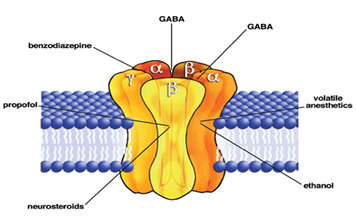
Figura 6. Estructura general de un receptor Gabaérgico (tomado de http://mineuronia.blogspot.com/2011/05/los-receptores-neuronales.html)
El receptor GABAA, se caracterizan por ser de tipo canales (semipermeables al ion cloruro), mientras que los receptores GABAB son receptores acoplados a proteína G (Bettler et al., 2004).
El papel del GABA es de gran importancia para determinar la fisiología de los ganglios basales ya que en la modulación de la transmisión GABAérgica se ha encontrado que receptores gabaérgicos tienen sitios activos para Dopamina, lo cual ocasiona interacciones dopamina-GABA, que pueden causar la disquinesia en los pacientes, esto dado a que un tipo de receptor GABA (que se encuentra en la parte lateral del globus pallidus y en la parte anterior del estriado)al interactuar con dopamina se inhibe. Por otro lado, un receptor GABA localizado en la parte posterior del estriado, pars reticulata y parte medial del globo pálido se ve excitado en la presencia de dopamina.
Se ha encontrado en estudios realizados a animales que la disminución de la actividad del GABA del pálido interno puede ocasionar el desarrollo de hiperquinesia, por lo tanto, se puede decir que la hiperquinesia está relacionada con la disminución de la enzima GABA decarboxilasa en el pálido interno y pars reticulata de cerebros de individuos con disquinesia.
Neurotransmisión colinérgica
Los receptores para acetilcolina de tipo nicotínico (R-nic) son canales catiónicos que se abren por la unión del neurotransmisor acetilcolina (AcCo). Estos receptores son proteínas de membrana compuestas por cinco subunidades y son la clave de la transmisión colinérgica nicotínica en la unión neuromuscular, así como en diferentes áreas del Sistema Nervioso Periférico (SNP) y Central (SNC), donde están ampliamente distribuidos. Los R-nic musculares y los del SNP están ubicados postsinápticamente, mediando respuestas excitadoras. En el SNC los R-nic se localizan preferentemente en las neuronas presinápticas, donde modulan la liberación de los neurotransmisores tales como la dopamina, la serotonina, el ácido g-aminobutírico, la noradrenalina, el AcCo y el glutamato.[8]
El mecanismo por el cual la modulación crónica del receptor nicotínico reduce la disquinesia sigue sin conocerse.
En los enfermos con Parkinson se ha identificado una disminución tanto de la inervación colinérgica como de la cantidad de R-nic.
Una teoría sugiere que la regulación negativa de los receptores nicotínicos dentro del núcleo del rafe después del tratamiento crónico con un agonista nicotínico podría conducir a una reducción en la liberación de dopamina a nivel rafeestrial y por lo tanto de las DIL. Pero esta teoría se ve contrarrestada con el hecho de que se ha visto, que tanto la estimulación y bloqueo de los receptores nicotínicos crónicamente produce un efecto anti disquinético.
Otros estudios sugieren la subunidad B2 de los receptores nicotínicos juega un rol importante en la liberación de dopamina, lo cual hace de la alteración en la liberación de dopamina a nivel nigroestrial el mecanismo antidisquinetico más probable de la modulación crónica de los receptores nicotínicos.
El uso de la nicotina y de los agonistas de R-nic tiene efectos benéficos en los pacientes con esta enfermedad. Se cree que la que la nicotina alivia las disquinesias después de un fenómeno de desensibilización que se produciría tras su administración crónica, pero posee el inconveniente de ser mal tolerada por los pacientes con enfermedad de Parkinson.
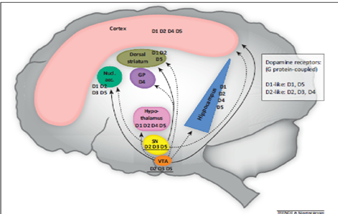
Figura 7. Advances in the pharmacological treatment of Parkinson's disease: targeting neurotransmitter systems.
La Inervación colinérgica y la distribución de los receptores de acetilcolina (ACh) en el cerebro. Las neuronas colinérgicas están situadas en el núcleo pedunculopontino (PPN) y los núcleos tegmentales dorsolateral en el tronco cerebral, así como en el núcleo basal de Meynert y el núcleo septal medial en el cerebro anterior basal. Estas neuronas proyectan axones a casi todas las otras áreas del cerebro. Por otra parte, el cuerpo estriado está muy inervado por las interneuronas colinérgicas. A nivel molecular, los efectos de ACh son mediados a través de los receptores nicotínicos y los receptores muscarínicos. Los receptores muscarínicos se expresan a una densidad mucho mayor en el cerebro que los nicotínicos. Nueve subunidades diferentes de receptores muscarínicos (a2- a7 y b2 - B4) se han detectado en el cerebro de los mamíferos, y diversas combinaciones de cinco subunidades son capaces de constituir un receptor funcional [70]. En el cuerpo estriado dorsal, análisis revelan la presencia de a5, a7, y b2-b4 ARNms. A6 mRNA se detectó en la sustancia negra humana (SN).
Neurotransmisión por taquicininas
Las taquiquininas son una familia de neuropéptidos que abarca la neuroquinina A, la neuroquinina B, y sustancia P. No se ha podido establecer con seguridad si los niveles elevados de estos neuropéptidos especialmente de la sustancia p se relacionan con la DILs.
Factores de transcripción y señalización intracelular
Factores de transcripción y cascadas intracelulares juegan un rol directo en el desarrollo o expresión de la disquinesia.
Estudios en modelos animales disquinéticos con lesiones por neurotoxina 6-hidroxidopamina (6-OHDA) arrojan un aumento en los niveles de FosB estriales en comparación con los niveles de FosB en animales no disquinéticos.
Otros estudios en modelos animales sugieren que la cascada que involucra DARPP-32, (fosfoproteína reguladas por cAMP) está alterada en la disquinesia, lo que conlleva a una fosforilación anormal de varias proteínas intracelulares como ERK1/2 y esto a su vez repercute a nivel nuclear, propiciando cambios en la estructura de algunas histonas en el cuerpo estriado de estos animales disquinéticos como la desfosforilación y la desacetilación de las mismas.
Otros aspectos relacionados
Parece que la DILs está relacionada con un aumento en la proliferación endotelial asociada con altos niveles de factor de crecimiento vascular endotelial (VEGF) en modelos animales. Otros estudios asocian la DILs con el aumento de la permeabilidad de la barrera hematoencefálica, con el aumento de IL-1 y con el aumento en la liberación de la hormona tirotropina que se cree aumenta la liberación de GABA en el complejo estriado-GPI/SNr.
Estudios en modelos animales sugieren que la administración crónica de ácido graso omega 3 ácido docosahexaenoico posee un efecto antidisquinésico. Aunque no el mecanismo no está muy claro algunas evidencias experimentales que una ingesta excesiva de grasas puede incrementar la vulnerabilidad a la enfermedad de Parkinson.
Altos niveles de factor de crecimiento vascular endotelial en modelos animales (VEGF) en modelos animales, el aumento en la permeabilidad de la barrera sangre- cerebro, el aumento de interleucina 1, la inflamación y el aumento en la liberación de hormona tirotropina que se cree aumenta la liberación de GABA en el complejoo estriado-GPI/SNr.
Estudios sugieren un efecto antidisquinetico asociado a la administración crónica de ácido graso omega 3 ácido docosahexaenoico en modelos animales.
CONCLUSIONES
- Las Disquinesias inducidas por L-Dopa representan un deterioro serio y crónico en la calidad de vida de los pacientes con Enfermedad de Parkinson, por lo cual es de vital importancia la realización de más estudios en pacientes y en animales para revelar estrategias en el manejo de estas complicaciones.
- Varios sistemas de neurotransmisores no dopaminérgicos están perturbados en la enfermedad de Parkinson y esas alteraciones, así como las interacciones físicas y funcionales entre los diferentes sistemas de neurotransmisores, contribuyen sustancialmente al desarrollo de las manifestaciones de la EP.
- Los estudios farmacológicos en el hombre y en animales, sugieren que la disquinesia, depende de una disminución primaria de la neurotransmisión dopaminérgica causada por el tratamiento neuroléptico y secundariamente por una actividad dopaminérgica relativa, debida a hipersensibilidad del receptor sináptico, de un trastorno del equilibrio entre las funciones de los transmisores dopaminérgicos y colinérgicos y disfunciones eventuales de los neurotransmisores. Dichos estudios son la base para nuevas investigaciones que revelarán aún más sobre el mecanismo de acción de esta enfermedad.
- Existen bastantes estrategias farmacológicas y no farmacológicas que pueden ser mejor exploradas para el tratamiento de las Disquinesias inducidas por L-Dopa.
- Algunas estrategias farmacológicas son los antagonistas NMDA, los antagonista de receptores de glutamato metabolotrópicos, antagonistas AMPA, antagonistas de receptores α2 adrenérgicos, antagonistas del receptor de adenosina A2A, agonistas de receptores nicotínicos, agonistas parciales de dopamina, inhibidores de la Monoamino- oxidasa B, agonistas 5HT y algunos anticonvulsivantes. Muchos de ellos aún tienen su efectividad en controversia.
REFERENCIAS
[1] Clavero-Ibarra P, Gil-Alzueta MC. Abordaje práctico de las disquinesias en la enfermedad de Parkinson. Revista de Neurología 2012; Volumen 54 (Suplemento 5): S33-40.
[2] Aviles-Olmos I, Kefalopoulou Z, Foltynie T. Understanding and prevention of "therapy-" induced dyskinesias.
[3] Heumann R, Moratalla R, Herrero MT, Chakrabarty K, Drucker-Colín R,Garcia-Montes JR, Simola N, Morelli M. Dyskinesia in Parkinson's disease: mechanisms and current non pharmacological interventions. J Neurochem.
[4] Bargiotas P, Konitsiotis S. Levodopa-induced dyskinesias in Parkinson's disease: emerging treatments. Neuropsychiatr
[5] Cervantes-Arriaga A, Rodríguez-Violante M, Salmerón-Mercado M, Calleja-Castillo J, Corona T, Yescas P, Alonso-Vilatela E. [Incidence and determinants of levodopa-induced dyskinesia in a retrospective cohort of Mexican patients with Parkinson's disease].
[6] Hout P , Johnston T, Koprich J., Fox S.. , and Brotchie J.[The Pharmacology of L-DOPA-Induced Dyskinesia in Parkinson
[7] Medina Marín A., Escobar Betancourth M. [Sistema glutamatérgico,primera parte: Sinaptología, homeostasis y muerte celular.] Revista Colombiana de Psiquiatría,vol. XXXI, núm. 3, pp. 187-212, Asociación Colombiana de Psiquiatría Colombia ISSN
[8] Calunga, J. López Valdés, H. La participación de los receptores de acetilcolina nicotínicos en trastornos del Sistema Nervioso Central. Salud mental, ISSN 0185-3325, Vol. 26, Nº. 3, 2003 , págs. 66-72.
[9] Henry B, Fox SH, Crossman AR, and Brotchie JM (2001) Mu- and delta-opioid re- ceptor antagonists reduce levodopa-induced dyskinesia in the MPTP-lesioned pri- mate model of Parkinson’s disease. Exp Neurol 171:139–146.
[10] Aubert I, Guigoni C, Håkansson K, Li Q, Dovero S, Barthe N, Bioulac BH, Gross CE, Fisone G, and Bloch B, et al. (2005) Increased D1 dopamine receptor signaling in levodopa-induced dyskinesia. Ann Neurol 57:17–26.
[11] Página web: Psicofármacos.info para profesionales y consufmidores. Efectos adversos de los antipsicoticos. (Versión en línea): Disponible en: http://www.psicofarmacos.info/?contenido=antipsicoticos&farma=taractan-truxal.

Diego Lara
Docente CTB



Ingresa tu comentario